Lý Thuyết Hóa Hữu Cơ 11: Đại Cương Hóa Hữu Cơ Và Hiđrocacbon
Hóa hữu cơ là một phần kiến thức rất rộng. Để tìm hiểu rõ hơn về hóa hữu cơ, hãy cùng VUIHOC tìm hiểu về cách phân loại, gọi tên, công thức hóa học, các thành phần liên kết, đồng đẳng, đồng phân và các loại hidrocacbon qua bài viết sau.

1. Khái niệm hóa hữu cơ
Hợp chất hữu cơ là các hợp chất của cacbon (trừ các hợp chất đơn giản như CO, CO2, HCN, các muối cacbonat, muối xianua hay muối cacbua,…).
Hóa học hữu cơ là ngành hóa học nghiên cứu về các hợp chất hữu cơ.
- Đặc điểm cấu tạo:
-
Bắt buộc phải chứa nguyên tử Cacbon (C) trong thành phần của hợp chất hữu cơ. Các nguyên tử C liên kết với nhau và liên kết với các nguyên tử khác, thường là với Hidro (H), sau đó đến Oxy (O), Nito (N), một số hợp chất chứa cả lưu huỳnh (S) và Photpho (P),…
-
Liên kết hóa học trong các hợp chất hữu cơ chủ yếu là liên kết cộng hóa trị.
Các phản ứng thường diễn ra chậm và không xảy ra hoàn toàn, không diễn ra theo một hướng nhất định.
Số lượng các hợp chất hữu cơ lên đến khoảng 10 triệu chất, nhiều hơn hẳn so với số lượng các chất vô cơ chỉ có khoảng 100.000 chất.
- Tính chất vật lý:
-
Dễ bay hơi, nhiệt độ nóng chảy và nhiệt độ sôi thấp, kém bền với nhiệt độ, dễ cháy hơn so với các hợp chất vô cơ.
-
Đa số các hợp chất hữu cơ không tan trong nước nhưng tan nhiều trong các dung môi hữu cơ.
- Tính chất hóa học :
-
Hầu hết các phản ứng thường diễn ra chậm không xảy ra hoàn toàn và diễn ra theo nhiều chiều hướng khác nhau, tạo ra hỗn hợp nhiều sản phẩm.
2. Phân loại và gọi tên các hợp chất hữu cơ
2.1. Phân loại các hợp chất hữu cơ
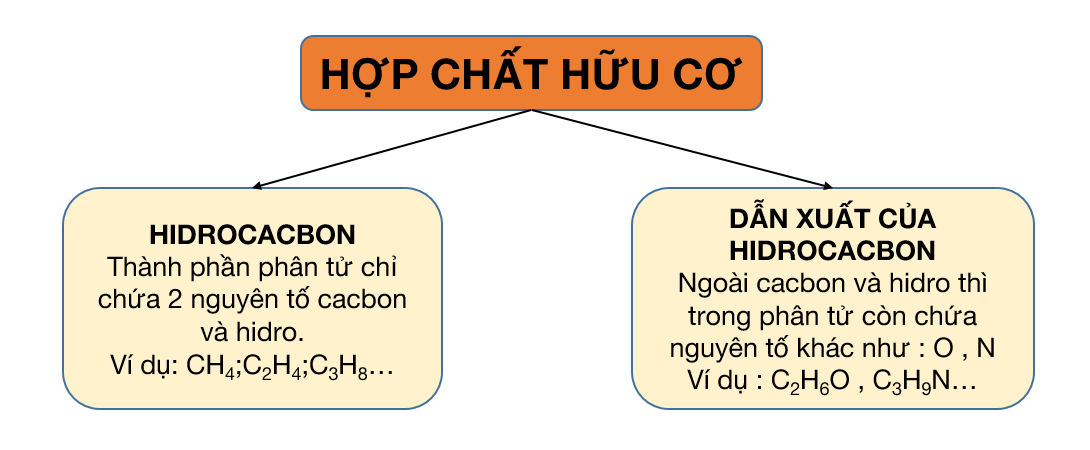
Hợp chất hữu cơ thường được phân thành 2 loại:
- Hiđrocacbon: Trong phân tử chỉ chứa hai nguyên tố là C và H. Hiđrocacbon lại được chia thành các nhóm nhỏ.
-
Hiđrocacbon no: chỉ có các liên kết đơn (CH4, C2H6,…)
-
Hiđrocacbon không no: có cả các liên kết đơn và liên kết đôi, liên kết ba (C2H4, C2H2,…)
-
Hiđrocacbon thơm: có vòng benzen trong phân tử (C6H6, C7H8,…).
- Dẫn xuất của hidrocacbon: Trong phân tử ngoài các nguyên tố C và H thì còn chứa các nguyên tố khác như O, N, Cl, S, P,…
-
Dẫn xuất halogen: CH3Cl, C6H5Br,…
-
Ancol: CH3OH, C2H5OH,…
-
Axit: CH3COOH,...
-
Anđehit: HCHO, CH3CHO,…
-
Phenol: C6H5OH,…
-
Xeton: CH3COCH3,…
-
Este: CH3COOC2H5,…
-
Ete: CH3CH2OCH2CH3,…

Phân loại theo dạng mạch Cacbon:
- Mạch hở: Các nguyên tố hóa học cấu trúc nên mạch ở dạng thẳng hoặc không đóng thành vòng khép kín.
-
Mạch thẳng: Cấu trúc mạch ở dạng thẳng.
-
Mạch nhánh: Cấu trúc mạch có phân nhánh.
- Mạch vòng: Các nguyên tố hóa học cấu trúc nên mạch đóng vòng lại thành dạng vòng khép kín.
-
Đồng vòng: các nguyên tử Cacbon đóng vòng lại tạo thành vòng khép kín.
-
Dị vòng: Vòng khép kín được tạo thành từ các nguyên tử C và có sự tham gia của các nguyên tử của nguyên tố hóa học khác như O, N,…
2.2. Gọi tên các hợp chất hữu cơ (Danh pháp hữu cơ)
2.2.1. Tên gọi hệ thống theo danh pháp IUPAC
Tên gốc - chức: tên phần gốc + tên phần định chức

Tên thay thế: tên phần thế + tên mạch C chính + tên phần định chức

Để gọi tên một cách chính xác các hợp chất hữu cơ, các em cần học thuộc cách gọi tên các số đếm và tên mạch C chính.
|
Số đếm |
Tên |
Mạch Cacbon chính |
Tên |
|
1 |
mono |
C |
Met |
|
2 |
di |
C - C |
Et |
|
3 |
tri |
C - C - C |
Prop |
|
4 |
tetra |
C - C - C - C |
But |
|
5 |
penta |
C - C - C - C - C |
Pent |
|
6 |
hexa |
C - C - C - C - C - C |
Hex |
|
7 |
hepta |
C - C -C - C - C - C - C |
Hep |
|
8 |
octa |
C - C - C - C - C - C - C - C |
Oct |
|
9 |
nona |
C - C - C - C - C - C - C - C - C |
Non |
|
10 |
deca |
C - C - C -C - C - C - C - C - C - C |
Dec |
Tên các gốc Hidrocacbon cần biết:
-
Tên gốc = tên mạch cacbon + “yl”
Ví dụ: CH3 – : metyl, C2H5 -: etyl
-
Các gốc riêng:
Ví dụ:
-
CH2 = CH - : vinyl
-
CH2 = CH - CH2 – : anlyl
2.2.2. Tên gọi thông thường
Tên thông thường của các hợp chất hữu cơ thường được đặt theo nguồn gốc tìm ra chúng, một số có thể có phần đuôi để chỉ rõ hợp chất thuộc loại nào.
Ví dụ :
-
HCOOH: axit fomic (formica ⇔ Kiến).
-
CH3COOH: axit axetic (acetus ⇔ Giấm).
-
C10H20O: mentol (mentha piperita ⇔ Bạc hà).
3. Công thức phân tử hợp chất hữu cơ
3.1. Công thức tổng quát (CTTQ)
Cho biết thông tin về các nguyên tố có trong phân tử hợp chất hữu cơ.
Ví dụ: ứng với công thức tổng quát CxHyOzNt, ta biết hợp chất hữu cơ này được cấu tạo từ các nguyên tố C, H, O và N.
3.2. Công thức đơn giản nhất (CTĐGN)
3.2.1. Định nghĩa
Công thức đơn giản nhất là công thức thể hiện tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
3.2.2. Cách thiết lập công thức đơn giản nhất
Thiết lập công thức đơn giản nhất của HCHC CxHyOzNt nghĩa là thiết lập tỉ lệ:
-
x : y : z : t = (mC/12) : (mH/1) : (mO/16) : (mN/14)
-
x : y : z : t = (%mC/12) : (%mH/1) : (%mO/16) : (%mN/14)
3.2.3. Công thức thực nghiệm (CTTN)
-
Công thức thực nghiệm = (CTĐGN)n (trong đó n: số nguyên dương và CTĐGN: Công thức đơn giản nhất). Xác định n để tìm CTTN
3.3. Công thức phân tử
3.3.1. Định nghĩa
Công thức phân tử là công thức thể hiện số lượng nguyên tử của mỗi nguyên tố trong cấu trúc phân tử của nó.
3.3.2. Cách thiết lập công thức phân tử
Có ba cách để thiết lập công thức phân tử
Cách 1: Dựa vào thành phần % khối lượng các nguyên tố
-
Cho công thức phân tử CxHyOz, ta có tỉ lệ:
-
M/100 = 12.x/(%mC) = 1.y/(%mH) = 16.z/(%mO)
-
Từ đó ta có :
-
x = M.%mC/(12.100);
-
y = M.%mH/(1.100);
-
z = M.%mO/(16.100);
Cách 2: Dựa vào CTĐGN (công thức đơn giản nhất).
Bước 1: Đặt công thức phân tử (CTPT) của hợp chất hữu cơ là: (CTĐGN)n (với n ∈ N)
Bước 2: Tính độ bất bão hòa (k) của phân tử (chỉ áp dụng cho hợp chất hữu cơ có chứa liên kết cộng hóa trị, không áp dụng cho hợp chất có liên kết ion).
Bước 3: Dựa vào biểu thức k để chọn giá trị n, từ đó tìm ra CTPT (công thức phân tử) của hợp chất hữu cơ.
-
Giả sử một hợp chất hữu cơ có CTPT (công thức phân tử) là CxHyOzNt thì tổng số liên kết $\pi$ và vòng của phân tử được gọi là độ bất bão hòa của phân tử đó.
-
Công thức tính độ bất bão hòa (k).
-
k = (2x+2+t-y)/2 (k: tổng số liên kết $\pi$ và vòng)
-
y = 2x+2+t-2k
-
Cách 3: Tính trực tiếp theo khối lượng của sản phẩm cháy
Phương trình phản ứng cháy: CxHyOzNt + (x+y/4–z/2) O2 → xCO2 + (y/2)H2O + (t/2)N2
-
Áp dụng định luật bảo toàn nguyên tố: nC= nCO2; nH= 2.nH2O; nN= 2.nN2
-
Áp dụng định luật bảo toàn khối lượng: mHCHC = mC + mH + mO + mN + … = mtổng khối lượng các nguyên tố
Sản phẩm cháy của hợp chất hữu cơ như CO2, H2O,... được hấp thu vào các bình:
-
Sản phẩm là các chất hút nước là H2SO4 đặc, P2O5, các muối khan → khối lượng bình tăng chính là khối lượng nước;
-
Các bình hấp thu CO2 thường là dung dịch bazơ → khối lượng bình tăng chính là khối lượng CO2.
-
Thường gặp trường hợp bài toán sẽ cho hỗn hợp sản phẩm cháy (CO2 và H2O) vào bình đựng nước vôi trong hoặc vào dung dịch Ba(OH)2 thì:
-
Khối lượng bình tăng: m↑ = mCO2 + mH2O
-
Khối lượng dung dịch tăng: mdd↑ = (mCO2 + mH2O) – mkết tủa
-
Khối lượng dung dịch giảm: mdd↓= mkết tủa – (mCO2 + mH2O)
4. Phân tích nguyên tố trong hợp chất hữu cơ
4.1. Phân tích định tính
Mục đích: Xác định những nguyên tố nào có mặt trong thành phần hợp chất hữu cơ.
Nguyên tắc: Chuyển các nguyên tố có mặt trong hợp chất hữu cơ thành các chất vô cơ đơn giản sau đó nhận biết chúng bằng các phản ứng đặc trưng.

4.2. Phân tích định lượng
Mục đích: Xác định thành phần % về khối lượng của các nguyên tố có mặt trong phân tử hợp chất hữu cơ.
Nguyên tắc: Cân chính xác khối lượng của hợp chất hữu cơ. Sau đó chuyển nguyên tố C thành CO2, H thành H2O, N thành N2 rồi xác định chính xác khối lượng hoặc thể tích của các chất tạo thành. Từ đó tính được % khối lượng các nguyên tố.

Xác định khối lượng mol phân tử:
+ Dựa vào tỉ khối của chất hữu cơ so với không khí hoặc so với H2: MA = 29.dA/KK hoặc MA = 2.dA/H2
+ Các chất khó bay hơi hoặc không bay hơi được xác định bằng phương pháp nghiệm lạnh hoặc nghiệm sôi.
PAS VUIHOC – GIẢI PHÁP ÔN LUYỆN CÁ NHÂN HÓA
Khóa học online ĐẦU TIÊN VÀ DUY NHẤT:
⭐ Xây dựng lộ trình học từ mất gốc đến 27+
⭐ Chọn thầy cô, lớp, môn học theo sở thích
⭐ Tương tác trực tiếp hai chiều cùng thầy cô
⭐ Học đi học lại đến khi nào hiểu bài thì thôi
⭐ Rèn tips tricks giúp tăng tốc thời gian làm đề
⭐ Tặng full bộ tài liệu độc quyền trong quá trình học tập
Đăng ký học thử miễn phí ngay!!
5. Hiện tượng đồng đẳng và đồng phân
5.1. Đồng đẳng
Những hợp chất hữu cơ có thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 nhưng có tính chất hoá học tương tự nhau được gọi là những chất đồng đẳng với nhau, chúng hợp thành dãy đồng đẳng.
Giải thích: Mặc dù các chất trong cùng dãy đồng đẳng có công thức phân tử (CTPT) khác nhau về số lượng nhóm CH2 nhưng do chúng có cấu tạo hoá học tương tự nhau nên có tính chất hoá học cũng tương tự nhau.
Ví dụ: Các hiđrocacbon trong dãy: CH4, C2H6, C3H8, C4H10, C5H12,… CnH2n+2, chất phía sau hơn chất liền trước 1 nhóm CH2 và đều có tính chất hoá học tương tự nhau.
5.2. Đồng phân
Những hợp chất có cấu tạo khác nhau nhưng có chung công thức phân tử gọi là những chất đồng phân.
Giải thích: Những chất đồng phân là những chất có cùng công thức phân tử nhưng có cấu tạo hoá học lại khác nhau, chẳng hạn etanol có cấu tạo H3C-CH2-OH, còn đimetyl ete có cấu tạo H3C-O-CH3, vì vậy mặc dù công thức phân tử giống nhau nhưng chúng là những chất khác nhau, có tính chất khác nhau.
→ Etanol (C2H5OH) và đimetyl ete (CH3OCH3) là 2 chất hoàn toàn khác nhau (tính chất khác nhau) nhưng lại có chung công thức phân tử là C2H6O.
6. Liên kết hóa học và các phản ứng hóa hữu cơ
6.1. Liên kết hóa học
6.1.1. Liên kết σ
Liên kết tạo bởi 1 cặp electron dùng chung được gọi là liên kết đơn. Liên kết đơn này thuộc loại liên kết σ. Liên kết đơn giữa 2 nguyên tử được biểu diễn bằng 2 dấu chấm hoặc 1 gạch nối.
6.1.2. Liên kết $\pi$
Liên kết tạo bởi 2 cặp electron dùng chung được gọi là liên kết đôi. Liên kết đôi này gồm 1 liên kết σ và 1 liên kết $\pi$, biểu diễn bằng 4 dấu chấm hoặc 2 gạch nối giữa 2 nguyên tử.
Liên kết tạo bởi 3 cặp electron dùng chung được gọi là liên kết ba. Liên kết ba này gồm 1 liên kết σ và 2 liên kết $\pi$, biểu diễn bằng 6 dấu chấm hoặc 3 gạch nối giữa 2 nguyên tử.
Liên kết đôi và liên kết ba gọi là liên kết bội.
6.2. Phản ứng hóa hữu cơ
6.2.1. Liên kết σ
Đây là liên kết bền nhất trong các loại liên kết cấu tạo nên hợp chất hữu cơ .
Là liên kết tạo thành nền tảng chính cho mạch cacbon.
Nếu không có liên kết σ giữa hai nguyên tử thì không thể hình thành liên kết $\pi$ giữa hai nguyên tử đó.
a. Phản ứng thế bẻ gãy liên kết C-H:
Bậc của Cacbon: Các Cacbon trong mạch C có bậc tương ứng với số Cacbon mà nó liên kết trực tiếp xung quanh.
Quy tắc phản ứng thế:
-
Khi liên kết C-H bị bẻ gãy thì theo thứ tự ưu tiên C-H của C bậc cao sẽ dễ bị gãy hơn.
-
Phản ứng thế của C-H xảy ra ở bất kỳ liên kết C-H nào trong phân tử hợp chất hữu cơ không chứa liên kết $\pi$ của C với C.
-
Tạo ra nhiều sản phẩm thế:
-
Sản phẩm chính: sản phẩm thế vào vị trí C bậc cao nhất.
-
Sản phẩm phụ: là sản phẩm thế vào các vị trí C còn lại.
-
Phương trình hóa học tổng quát:
-
CnH2n+2 + Cl2 -askt→ CnH2n+1Cl + HCl
-
CnH2n+1Cl : là nhiều chất (đồng phân) bao gồm sản phẩm chính lẫn sản phẩm phụ.
b. Phản ứng cracking bẻ gãy liên kết C-C:
Đây là phản ứng bẻ gãy mạch Cacbon khó xảy ra nên cần nhiệt độ (to), xúc tác (xt), áp suất (p) nhất định.
Phản ứng chỉ xảy ra ở hợp chất Ankan (hidrocacbon mạch hở không chứa liên kết $\pi$)
Phản ứng bẻ gãy tạo ra sản phẩm là 1 ankan và 1 anken:
Phương trình hóa học tổng quát:
-
CnH2n+2 –cracking→ CaH2a+2 + CbH2b
-
n = a + b.
-
1 mol ankan cracking tạo ra 2 mol sản phẩm (1 mol ankan + 1 mol anken).
6.2.2 Liên kết $\pi$
a. Phản ứng cộng vào liên kết $\pi$:
Trong liên kết C = C có 1 liên kết $\pi$ trong C ≡ C có 2 liên kết $\pi$ đều dễ dàng bị bẻ gãy để tạo thành các liên kết σ bền vững hơn.
Ví dụ :
-
CH2 = CH2 + Br2 → CH2Br – CH2Br
-
Nhận xét :
-
Liên kết $\pi$ giữa 2 Cacbon bị bẻ gãy để tạo thành 2 liên kết σ C-Br bền vững hơn.
-
Một $\pi$ phản ứng với 1 Br2.
-
-
Khi cộng vào thành phần bất đối xứng như HX ( H2O, HCl,…) thành phần X được ưu tiên gắn vào vị trí C bậc cao.
-
Sản phẩm chính: khi X gắn vào vị trí C bậc cao.
-
Sản phẩm phụ: khi X gắn vào các vị trí C còn lại.
-
Ví dụ :
-
CH2 = CH - CH3 + HCl → CH3 - CHCl - CH3 (sản phẩm chính)
-
CH2 = CH - CH3 + HCl → CH2Cl - CH2 - CH3 (sản phẩm phụ)
-
b. Phản ứng trùng hợp – liên kết $\pi$:
Là phản ứng bẻ gãy liên kết $\pi$ để tạo ra liên kết σ kết nối các phân tử monome tạo thành phân tử lớn hơn (đime, trime,… polime)
Ví dụ :
-
dime: 2 CH ≡ CH (axetilen) → CH ≡ C - CH = CH2 (nhiệt độ, xúc tác, áp suất) (vinyl axetilen)
-
n CH2 = CHCl (vinyl clorua) → ( CH2-CHCl ) n (poli vinyl clorua hay còn gọi là P.V.C)
c. Phản ứng thế của H linh động:
Xét hợp chất R - C ≡ CH : H trong trường hợp này là H linh động có khả năng tạo phản ứng thế với:
-
Kim loại mạnh giải phóng H2.
-
AgNO3/NH3 tạo kết tủa muối Ag.
-
Ví dụ :
-
R - C ≡ CH + Na → R - C ≡ CNa + H2
-
R - C ≡ CH + Ag2O → R - C ≡ CAg (kết tủa) + H2O (Ag2O là thành phần tượng trưng cho dd AgNO3/NH3)
-
Tham khảo ngay bộ tài liệu ôn tập kiến thức và phương pháp giải mọi dạng bài tập về hóa học hữu cơ trong đề thi Hóa THPT Quốc Gia ngay
7. Lý thuyết hóa hữu cơ: Hiđrocacbon
7.1. Ankan
Dãy đồng đẳng ankan (parafin): Công thức tổng quát (CTTQ): CnH2n + 2 (n ≥ 1).
Ví dụ: CH4, C2H6, C3H8, C4H10, C5H12,....
Đồng phân:
-
Chỉ có đồng phân mạch C (dạng mạch thẳng, mạch nhánh).
-
Cách viết đồng phân:
-
Viết mạch C thẳng. Ta được đồng phân đầu tiên mạch thẳng.
-
Giảm 1 C làm nhánh, xét tính đối xứng của mạch để gắn C vào nhánh, đến khi số C làm nhánh bằng với số C của mạch chính thì dừng lại.
-
Bổ sung thêm các nguyên tử H để thu được đồng phân hoàn chỉnh.
-
Công thức tính nhanh của ankan: 3 < n < 7
Danh pháp:
-
Chọn mạch chính: là mạch dài nhất, nhiều nhánh nhất.
-
Đánh số: C số 1 được quy ước là C gần mạch nhánh nhất.
-
Tên: Số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính + an.

-
Bậc C: số nguyên tử C mà liên kết với C đang xét: C bậc 1 liên kết với 1 C xung quanh; C bậc 2 liên kết với 2 C xung quanh; C bậc 3 liên kết với 3 C xung quanh.

Tính chất vật lý
-
Nhẹ hơn nước và gần như không tan trong nước, tan nhiều trong các dung môi hữu cơ.
-
Trong điều kiện thường, C1 → C4 ở dạng khí, các ankan tiếp theo (C5 → C17) ở dạng lỏng, C18 trở đi ở dạng rắn.
-
Đặc điểm: Chỉ gồm các liên kết đơn.
Tính chất hóa học
-
Phản ứng thế là một phản ứng đặc trưng của ankan. Nguyên tử H (ưu tiên H ở C bậc cao) trong ankan bị thay thế bởi nguyên tố halogen trong điều kiện có ánh sáng hoặc đun nóng.

-
Phản ứng tách: Dưới nhiệt độ và xúc tác thích hợp, ankan có phân tử khối nhỏ bị tách thành các anken tương ứng.

Ứng dụng của Ankan

7.2. Anken
Dãy đồng đẳng anken (olefin): Công thức tổng quát là CnH2n (n ≥ 2).
Đồng phân: Anken có 2 loại đồng phân là đồng phân cấu tạo (mạch C và vị trí nối đôi) và đồng phân hình học.
-
Đồng phân cấu tạo:
-
Cách viết đồng phân: Viết mạch C thẳng. Xét tính đối xứng để đặt vị trí liên kết đôi phù hợp. Ta thu được các đồng phân mạch thẳng.
-
Tách 1 C ra làm nhánh, xét tính đối xứng để gắn C nhánh và vị trí nối đôi, kiểm tra hoá trị của C. Tiếp tục viết các vị trí nhánh khác nhau đến khi số C làm nhánh bằng với số C của mạch chính thì dừng lại.
-
Bổ sung thêm các nguyên tử H để thu được đồng phân hoàn chỉnh.

-
Khi 2 nhóm thế của nguyên tử C mang nối đôi khác nhau thì sẽ làm xuất hiện đồng phân hình học. Nếu các nhóm thế (-CH3, -C2H5, -Cl,...) có phân tử khối lớn hơn nằm cùng về 1 phía với nối đôi sẽ thu được đồng phân dạng cis. Nếu các nhóm thế có phân tử khối lớn hơn nằm khác phía sẽ thu được đồng phân dạng trans.

Danh pháp:
-
Chọn mạch chính: là mạch C dài nhất, có chứa nối đôi và nhiều nhánh nhất.
-
Đánh số: C số 1 tính từ C gần vị trí nối đôi nhất.
-
Tên: Số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính – số chỉ vị trí nối đôi – en.

Đặc điểm cấu tạo: mạch hidocacbon phải có một liên kết đôi, trong đó có một liên kết π và một liên kết σ.
Tính chất vật lí:
-
Nhẹ hơn nước, không tan trong nước.
-
Trong điều kiện thường, C2 → C4 tồn tại ở dạng khí, C5 trở đi tồn tại ở dạng lỏng hoặc rắn.
-
Khi phân tử khối (M) tăng, nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng cũng sẽ tăng theo.
Tính chất hoá học của anken:
-
Phản ứng đặc trưng là phản ứng cộng (vì có liên kết π dễ bị phá huỷ, kém bền):

-
Anken nếu cộng H2 sẽ sinh ra ankan tương ứng; nếu cộng với halogen hay hợp chất halogen sẽ sinh ra dẫn xuất của halogen; nếu cộng với nước sẽ sinh ra ancol tương ứng.
-
Quy tắc Maccopnhicop: Khi Anken cộng với các hợp chất không đối xứng HX (HCl, HBr, H2O), H ưu tiên gắn vào vị trí C bậc thấp, còn X ưu tiên gắn vào vị trí C bậc cao.
- Phản ứng trùng hợp

- Phản ứng oxy hóa

- Phản ứng làm mất màu dung dịch KMnO4 và mất màu dung dịch brom là 2 phản ứng đặc trưng dùng để nhận biết anken.
Ứng dụng của anken:

7.3. Ankin
Ankin là các hiđrocacbon mạch hở mà trong phân tử có chứa một nối ba.
Công thức tổng quát: CnH2n - 2 ( n ≥ 2).
Đồng phân: Ankin có đồng phân mạch C và đồng phân vị trí nối ba, ankin không có đồng phân hình học. Cách viết đồng phân:
-
Viết mạch C thẳng. Xét tính đối xứng của mạch C để đặt vị trí liên kết ba. Ta thu được đồng phân mạch thẳng.
-
Tách 1 C làm nhánh, xét tính đối xứng để gắn C nhánh và vị trí nối ba, kiểm tra hoá trị của C. Tiếp tục viết các vị trí nhánh khác nhau đến khi số C ở làm nhánh bằng với số C của mạch chính thì dừng lại.
-
Bổ sung thêm các nguyên tử H để thu được đồng phân hoàn chỉnh.

Danh pháp:
-
Gọi tên
-
Chọn mạch chính: là mạch C dài nhất, có chứa nối ba và nhiều nhánh nhất.
-
Đánh số:C số 1 tính từ C gần vị trí nối ba nhất.
-
Tên: Số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính – số chỉ vị trí nối ba – in.
-

-
Tên gọi thường:
Ví dụ:
-
CH ☰ CH: axetilen
-
CH ☰ C - CH3: metylaxetilen
-
CH ☰ C - CH2 - CH3: etylaxetilen
-
CH3 - C ☰ C - CH3: dimetylaxetilen
Tính chất hóa học:
-
Phản ứng cộng

-
Phản ứng nhị hợp, tam hợp của axetilen
-
Phản ứng thế: nhận biết ank - 1 - in

-
Phản ứng oxy hóa

-
Ứng dụng của Ankin:

7.4. Ankađien
Ankađien là các hidrocacbon mạch hở mà trong phân tử có chứa 2 nối đôi.
Công thức tổng quát: CnH2n - 2 (n ≥ 3)
Phân loại:
-
Ankađien có 2 nối đôi liên tiếp nhau
-
Ankađien có 2 nối đôi cách một nối đơn (hay còn gọi là ankađien liên hợp, ankadien loại này được ứng dụng nhiều nhất)
-
Ankađien có 2 nối đôi cách nhau nhiều nối đơn,....
Tính chất hoá học: Ankađien có các tính chất hoá học tương tự như anken.


Ứng dụng của ankadien: điều chế các polime có tính đàn hồi cao dùng trong sản xuất cao su.
Tham khảo ngay bộ tài liệu tổng ôn kiến thức và phương pháp giải mọi dạng bài tập trong đề thi Hóa THPT Quốc gia
7.5. Dãy đồng đẳng benzen
Đồng đẳng benzen là những hiđrocacbon thơm mà trong phân tử chứa một vòng benzen.
Công thức tổng quát: CnH2n-6 (n ≥ 6).
Công thức tính đồng phân: (n - 6)2 (7 ≤ n ≤ 9)
-
Viết đồng phân: Đồng đẳng benzen có đồng phân về vị trí nhóm ankyl trên vòng và cấu tạo mạch C của nhánh.
-
Vòng benzen được quy ước luôn là mạch chính.
-
6 vị trí C trên vòng benzen chính là 6 vị trí để gắn nhánh.
-
Nếu số C của nhánh từ 3 trở lên sẽ có đồng phân cấu tạo mạch C của nhánh.
Tên gọi: Tên nhóm ankyl + benzen.
-
Đánh số sao cho chỉ số nhánh là nhỏ nhất.
-
Nếu 2 nhóm thế ở vị trí 1 và 2 với nhau, ta gọi là ortho- (o-).
-
Nếu 2 nhóm thế ở vị trí 1 và 3 với nhau, ta gọi là meta- (m-).
-
Nếu 2 nhóm thế ở vị trí 1 và 4 với nhau, ta gọi là para- (p-)

Đặc điểm cấu tạo: Vòng benzen rất bền vững vì có 3 liên kết đơn xen kẽ giữa 3 liên kết đôi.
Tính chất hoá học:
-
Phản ứng thế:
-
Khi có xúc tác Fe, nhiệt độ sẽ xảy ra phản ứng thế vào nhân thơm.
-
Khi có ánh sáng, nhiệt độ sẽ xảy ra phản ứng thế vào vị trí nhánh.
-
-
Quy tắc thế vào nhân benzen:
-
Khi vòng benzen đã có sẵn nhóm thế ankyl thì các nhóm thế tiếp theo ưu tiên thế vào vị trí ortho và para (2, 4, 6).
-
Khi vòng benzen đã có sẵn nhóm thế COOH, gốc R chứa liên kết đôi, NO2, nhóm thế tiếp theo được ưu tiên thế vào các vị trí meta (3, 5).
-


-
Phản ứng oxy hóa
-
Oxy hóa không hoàn toàn: benzen và toluen không làm mất màu KMnO4 trong điều kiện thường nhưng khi đun nóng cách thủy, toluen tạo ra kết tủa MnO2 và làm mất màu KmnO4.
-


- Oxy hóa hoàn toàn

Ứng dụng của benzen:

PAS VUIHOC – GIẢI PHÁP ÔN LUYỆN CÁ NHÂN HÓA
Khóa học online ĐẦU TIÊN VÀ DUY NHẤT:
⭐ Xây dựng lộ trình học từ mất gốc đến 27+
⭐ Chọn thầy cô, lớp, môn học theo sở thích
⭐ Tương tác trực tiếp hai chiều cùng thầy cô
⭐ Học đi học lại đến khi nào hiểu bài thì thôi
⭐ Rèn tips tricks giúp tăng tốc thời gian làm đề
⭐ Tặng full bộ tài liệu độc quyền trong quá trình học tập
Đăng ký học thử miễn phí ngay!!
Trên đây là toàn bộ những thông tin cần thiết liên quan đến hóa hữu cơ. Đây là một nội dung rất lớn và rất quan trọng trong chương trình ôn thi Hóa THPT Quốc gia và yêu cầu các em phải nắm thật chắc, chúc các em có sự chuẩn bị tốt nhất nhất trong quá trình ôn thi Hóa THPT Quốc gia. Ngoài ra, em có thể truy cập ngay Vuihoc.vn để xem thêm các bài giảng hoặc liên hệ trung tâm hỗ trợ để nhận thêm nhiều bài giảng và được chuẩn bị kiến thức tốt nhất cho kỳ thi THPT quốc gia sắp tới nhé!
Tham khảo thêm:
⭐Bộ Sách Thần Tốc Luyện Đề Toán - Lý - Hóa THPT Có Giải Chi Tiết


















